Structure & dynamique de macromolécules
Caractérisation structurale et dynamique de protéines ou de complexes ligand-protéine par RMN et cristallographie aux rayons X
La plateforme PICT propose à la communauté scientifique locale, nationale et internationale l’expertise et l’accès à différentes techniques/équipements de pointe combinant des approches de biologie structurale offrant un ensemble intégré de méthodes de caractérisation de la structure et de la dynamique des macromolécules:
- Structure tridimensionnelle de macromolécules ou systèmes supramoléculaires (protéines, acides nucléiques et protéines membranaires).
- Structure et dynamique des complexes supramoléculaires : études des interactions ligand-protéine, protéine-protéine, ac. nucléique-protéine.
- Dynamique des macromolécules protéine (RMN).
- Organisation et dynamique des membranes biologiques (RMN à l’état solide).
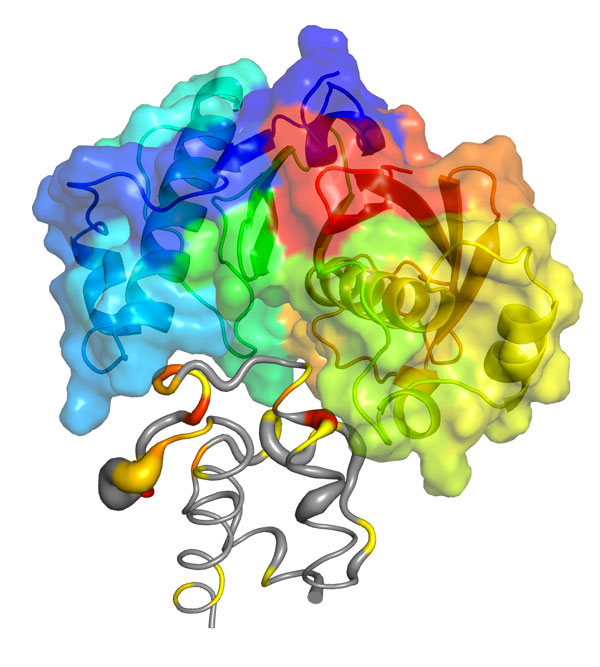
Prérequis
Toute étude structurale requiert un échantillon protéique pur chimiquement et oligomériquement. Cette pureté devra avoir été validée par analyse sur gel en conditions dénaturantes et chromatographie d’exclusion de taille. Quantité nécessaire de macromolécule : quelques milligrammes.
Offre de service
- Spectroscopie RMN
- Cristallographie aux rayons X
Structure & dynamique des macromolécules par RMN
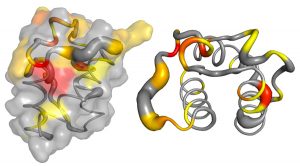
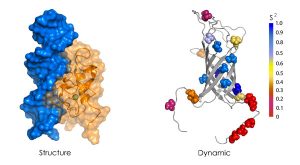
Le plateau de RMN biologique propose d’élucider la structure tridimensionnelle et la dynamique de macromolécules biologiques par spectroscopie RMN :
- Structure tridimensionnelle et étude dynamique de protéines
- Complexes protéiques : interaction ligand-protéine ou acide nucléique-protéine par RMN et approches biophysiques
- Interactions ligand – protéine
- Structure et dynamique des constituants membranaires
Ces applications peuvent être mises en œuvre sur des échantillons solubles (RMN en solution) ou sur des échantillons anisotropes (membranes biologiques, vésicules, solides mous, micro-cristaux, etc..) par RMN à l’état solide. Ces approches reposent sur l’expertise de l’équipe « RMN biologique Intégrative » de l’IPBS.
Cristallographie aux rayons X
La cristallographie aux rayons X permet de résoudre la structure tridimensionnelle à haute résolution de macromolécules et de leurs complexes. La connaissance du repliement de ces macromolécules s’avère essentielle pour la compréhension fondamentale des mécanismes moléculaires enzymatiques mais aussi pour l’amélioration des connaissances des cibles thérapeutiques et la découverte de nouvelles molécules bioactives.
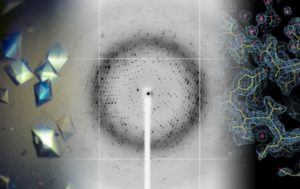
Le plateau de cristallographie possède les équipements et l’expertise pour accomplir les trois grandes étapes clés de la résolution de structure par cristallographie :
– la cristallisation, c’est-à-dire la détermination des conditions d’obtention de cristaux de protéines à partir d’un échantillon protéique pur et homogène et la cryocongélation des cristaux,
– la collecte et le traitement des données de diffraction du cristal,
– la résolution de la structure tridimensionnelle par les différentes méthodes (remplacement moléculaire, isomorphe ou diffusion anomale).
Ces approches reposent sur l’expertise de l’équipe « Biophysique Structurale » de l’IPBS.
Notre offre de service en biologie structurale couvre l’ensemble de nos expertises. Elle peut prendre differentes formes allant de la prestation de service à la collaboration scientifique. Une étude de faisabilité est souvent nécessaire.
Selon la problématique (étude structurale, dynamique, interaction) et la nature des macromolécules (taille, protéine, acide nucléique …) nous mettrons en œuvre l’approche la (les) plus adaptée(s) : spectroscopie RMN, cristallographie aux rayons X ou une combinaison des deux techniques. Les champs d’application et singularités de chaque approche sont décrits ci-dessous.